氯气与氢氧化钠反应*(氯气与氢氧化钠反应现象)
识点总结
原创2020-11-12 15:00百之灵
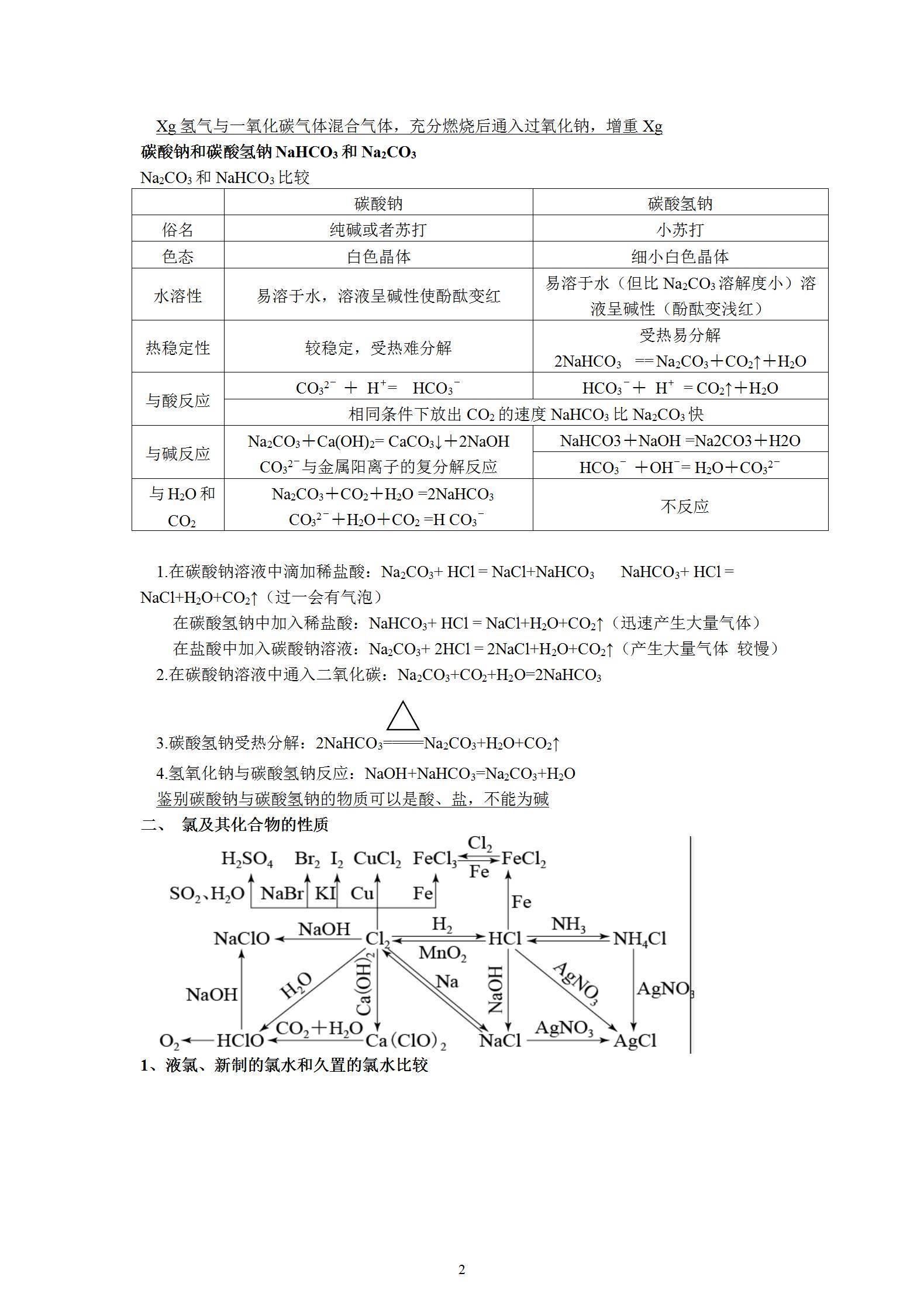






一、 钠及其化合物的性质
1.钠与空气反应
①钠在空气中缓慢氧化:4Na+O2==2Na2O ②钠在空气中燃烧:2Na+O2△(=====)Na2O2
1摩尔金属钠与氧气充分反应,转移电子1摩尔
2.钠与水反应
2Na+2H2O=2NaO百思特网H+H2↑ (反应物系数为2)
现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。(浮溶游响红)
钠与酸反应:先酸后水
钠与碱反应:与水
钠与盐反应:先水后盐
任何溶液中都有气体,若是饱和溶液或难溶物,还有沉淀
过氧化钠Na2O2
氧化物
Na2O
Na2O2
氧元素的化合价
―2
―1
生成条件
常温
加热
颜色、状态
白色固体
淡黄色粉末
与H2O的反应
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
与CO2的反应
Na2O+CO2= Na2CO3
2Na2O2+2CO2=2Na2CO3+O2↑
与酸的反应
Na2O+2HCl=2NaCl+ H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
热稳定性
不稳定,易被氧化成Na2O2
较稳定
漂白作用
无
有
1.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑(反应物系数为2)
2.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2 (反应物系数为2)
Xg氢气与一氧化碳气体混合气体,充分百思特网燃烧后通入过氧化钠,增重Xg
碳酸钠和碳酸氢钠NaHCO3和Na2CO3
Na2CO3和NaHCO3比较
碳酸钠
碳酸氢钠
俗名
纯碱或者苏打
小苏打
色态
白色晶体
细小白色晶体
水溶性
易溶于水,溶液呈碱性使酚酞变红
易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红)
热稳定性
较稳定,受热难分解
受热易分解
2NaHCO3 == Na2CO3+CO2↑+H2O
与酸反应
CO32- + H+= HCO3-
HCO3-+ H+ = CO2↑+H2O
相同条件下放出CO2的速度NaHCO3比Na2CO3快
与碱反应
Na2CO3+Ca(OH)2= CaCO3↓+2NaOH CO32-与金属阳离子的复分解反应
NaHCO3+NaOH =Na2CO3+H2O
HCO3- +OH-= H2O+CO32-
与H2O和CO2
Na2CO3+CO2+H2O =2NaHCO3
CO32-+H2O+CO2 =H CO3-
不反应
1.在碳酸钠溶液中滴加稀盐酸:Na2CO3+ HCl = NaCl+NaHCO3 NaHCO3+ HCl = NaCl+H2O+CO2↑(过一会有气泡)
在碳酸氢钠中加入稀盐百思特网酸:NaHCO3+ HCl = NaCl+H2O+CO2↑(迅速产生大量气体)
在盐酸中加入碳酸钠溶液:Na2CO3+ 2HCl = 2NaCl+H2O+CO2↑(产生大量气体 较慢)
2.在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO3
3.碳酸氢钠受热分解:2NaHCO3△(=====)Na2CO3+H2O+CO2↑
4.氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O
鉴别碳酸钠与碳酸氢钠的物质可以是酸、盐,不能为碱
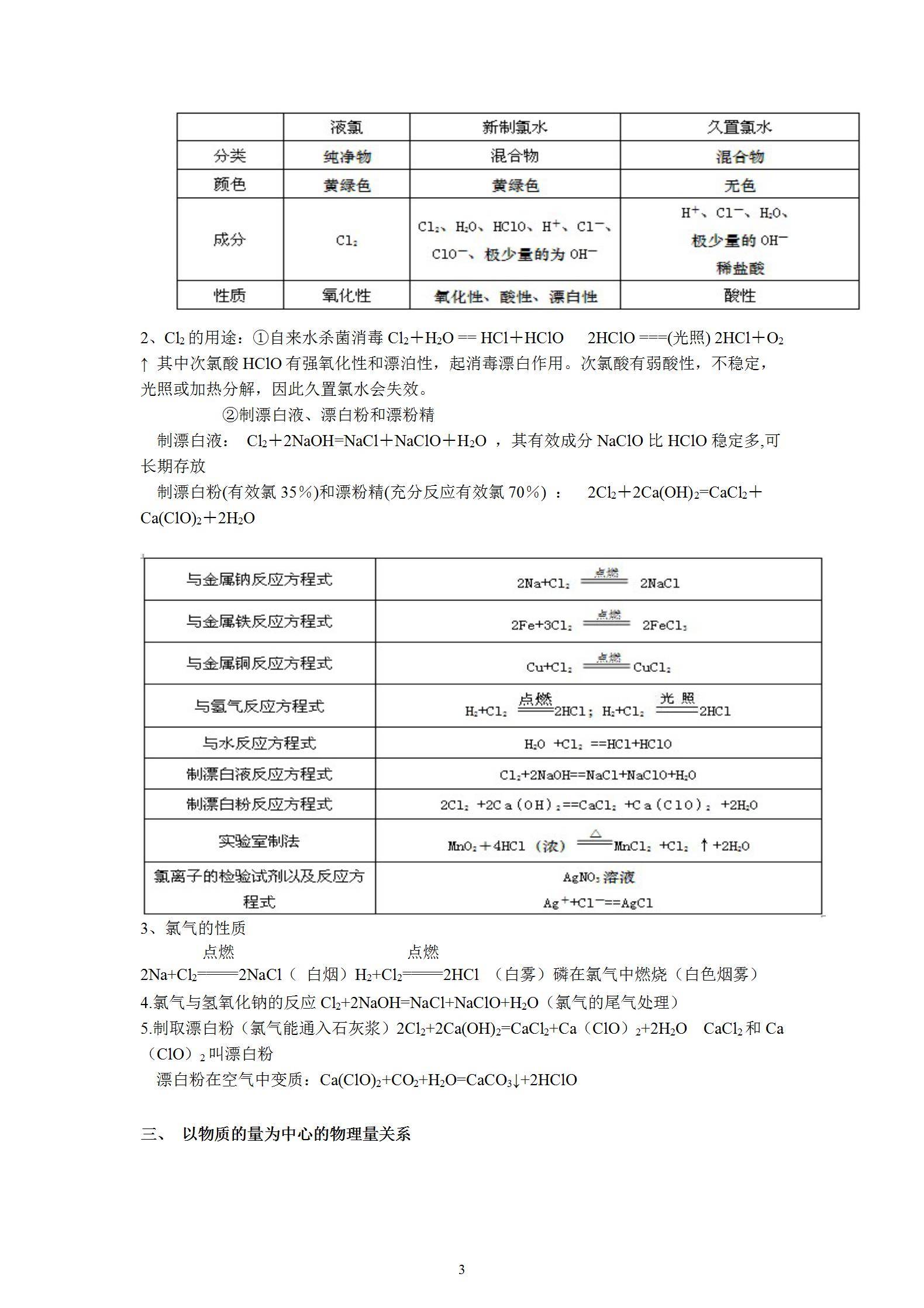
二、 氯及其化合物的性质
1、液氯、新制的氯水和久置的氯水比较
2、Cl2的用途:①自来水杀菌消毒Cl2+H2O == HCl+HClO 2HClO ===(光照) 2HCl+O2 ↑ 其中次氯酸HClO有强氧化性和漂泊性,起消毒漂白作用。次氯酸有弱酸性,不稳定,光照或加热分解,因此久置氯水会失效。
②制漂白液、漂白粉和漂粉精
制漂白液: Cl2+2NaOH=NaCl+NaClO+H2O ,其有效成分NaClO比HClO稳定多,可长期存放
制漂白粉(有效氯35%)和漂粉精(充分反应有效氯70%) : 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
3、氯气的性质
2Na+Cl2点燃(=====)2NaCl( 白烟)H2+Cl2点燃(=====)2HCl (白雾)磷在氯气中燃烧(白色烟雾)
4.氯气与氢氧化钠的反应Cl2+2NaOH=NaCl+NaClO+H2O(氯气的尾气处理)
5.制取漂白粉(氯气能通入石灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O CaCl2和Ca(ClO)2叫漂白粉
漂白粉在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
三、 以物质的量为中心的物理量关系
1.物理量-物质的量 单位-摩尔(mol)
①n= N/NA N代表微粒个数 NA阿伏加德罗常数 NA≈6.021023 mol-1
2.物质的摩尔质量M
②n= m/M
M代表物质质量 M为摩尔质量,数值上等于该物质的相对原子质量或相对分子质量,单位g•mol-1
3.气体的摩尔体积Vm
③n=V/Vm V为气体体积,单位是升(L) Vm是气体摩尔体积,标准状况下,1 mol气体为22.4 L
Vm温度、压强一定时为定值,Vm单位为L •mol -1
阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。所以又叫四同定律,也叫五同定律(五同指同温、同压、同体积、同分子个数、同物质的量)
推论:定律
(1)同温同压下,V1/V2=n1/n2
(2)同温同体积时,p1/p2=n1/n2=N1/N2
(3)同温同压等质量时,V1/V2=M2/M1
4.溶液中溶质的物质的量浓度c
④n=cV C为溶液中溶质的物质的量浓度,单位为mol• L -1 V为溶液体积,单位是升(L)
5.一定物质的量浓度溶液的配制及误差分析
(1)容量瓶是配制一定物质的量浓度溶







